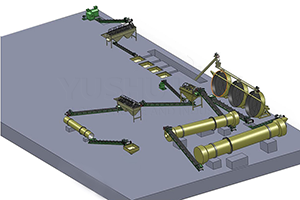
Waarlik, Daar is verskillende verskillende metodes vir die verkryging van kaliumsulfaat (K2SO4). Elkeen van hulle het sy eie eienskappe en toepaslike situasies. Die volgende inligting word ongeveer ses gewild gegee Kaliumsulfaatproduksieprosesse.
Mannheim vaardigheid
Dit is die tradisionele proses van kaliumsulfaat. In die Mannheim -proses, kaliumchloried (Kcl) en swaelsuur (H2SO4) reageer by hoë temperatuur in 'n spesiaal ontwerpte oond. As gevolg van die reaksie word kaliumsulfaat en gasvormige chloried waterstof gevorm (HCl). Chlorovoros kan versamel en gebruik word vir kommersiële doeleindes as 'n deur -produk. Hierdie proses verg hoë energieverbruik. En korrosie -weerstandige toerusting is ook nodig, in staat is om hoë temperature en aggressiewe gasse te weerstaan.
Die proses van dubbele ontbinding van sulfaat en kaliumchloried
In hierdie metode word kaliumsulfaat verkry Dubbele ontbinding reaksie Kalsiumsulfaat (CASO4) en kaliumchloried (Kcl) In waterige oplossing. Tydens die reaksie word kalsiumsulfaat eers in water opgelos met die vorming van ione. Dan reageer hy met kaliumchloried met die vorming van kaliumsulfaat en kalsiumchloried (Cacl2). Dit moet gewoonlik by sekere temperature en konsentrasies van die oplossing gedoen word, Om maksimum uitset en netheid te verseker.
Koelkristallisasiemetode
Koelkristallisasiemetode Gebruik die verskil in die oplosbaarheid van kaliumchloried en magnesiumsulfaat (MGSO4) Afhangend van die temperatuur. In hierdie metode kan magnesiumsulfaat en kaliumchloried onderskeidelik verkry word uit 'n onverwerkte oplossing, ontgin uit 'n myn of sout meer, Na 'n reeks stadiums van verdamping en verkoeling. Kaliumsulfaat word van die baarmoederoplossing geskei deur verdere verwerking, Byvoorbeeld, Kristallisasie tydens verkoeling.
Ion -inkomste -metode
Metode ion -uitruil - Moderne tegnologie vir die verkryging van kaliumsulfaat. Hy gebruik hars of ander ioon -uitruilmateriaal vir adsorpsie van kaliumione van oplossings, wat kalium bevat. Na versadiging van die hars van kaliumione kan uit die hars ontwyk word met behulp van 'n gekonsentreerde oplossing van swaelsuur. Ontvang dus kaliumsulfaat. Met hierdie metode kan u kalium uit verskillende bronne effektief onttrek, insluitend afvalwater en seewater.
Swaeliese ertsverbrandingsproses
In hierdie proses, swael -bevattende ertse (Byvoorbeeld, Piriet FES2) gemeng met kaliumchloried en hitte tot hoë temperature vir verbranding. Swaelsuur en sulfaatgas, die reaksie wat voortspruit uit, kan reageer met kaliumchloried met kaliumsulfaat. Hierdie proses los ook omgewingsprobleme op, swawel erts. Per slot van rekening kan swaelafval in gesonde chemiese produkte omskep word.
Elektrolise -metode Produksie van kaliumsulfaat
Elektrolise produseer kaliumsulfaat deur elektrolise van die oplossing, wat swaelsuur en kaliumchloried bevat. Tydens elektrolise breek die water in die oplossing op in waterstofione en suurstofione. Hulle reageer onderskeidelik op die katode en anode. Gedurende hierdie proses kan waterstofione aan die ione sulfaat gekoppel word met die vorming van kaliumsulfaat. Suurstofione kan gekombineer word met chloriedione met die vorming van gasvormige chloor.
Elke metode het sy eie voor- en nadele van. Byvoorbeeld, Die Mannheim -proses kan kaliumsulfaat van hoë suiwerheid produseer. Energieverbruik is egter groot, Die koste is hoog, En die vereistes vir die materiaal vir toerusting is hoog. Die dubbele ontbindingsproses is relatief eenvoudig. Deur -produkte kan egter vorm (soos kalsiumchloried), wat moeilik is om te hanteer. Die koelkristallisasiemetode is geskik vir die verwerking van K- en Mg -soute in natuurlike minerale of seewater. Die ioonmetabolisme -metode en elektrolise -metode is gewoonlik geskik vir die ontwikkeling van kaliumbronne van hoë suiwerheid. As u addisionele benodig Oplossings vir die produksie van kaliumsulfaat, Plesier, Kontak ons!